HILO CONDUCTOR
¿Qué porcentaje de carbono tiene la
nicotina?
TÓPICO GENERATIVO
Descifrando códigos secretos
- Masas atómicas, Masas
moleculares
- Estequiometria
- Formulas químicas
- Reacciones químicas
- Composición porcentual
- Balanceo de ecuaciones
quimicas
META ESPECÍFICA
El
estudiante comprenderá el cálculo de
fórmulas empíricas y moleculares, a partir de la composición porcentual de los
compuestos.
NOMENCLATURA INORGÁNICA
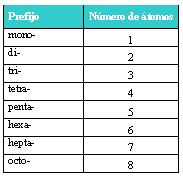
La nomenclatura IUPAC o Sistemática es una de las reglas para nombrar compuestos inorgánicos más usadas en la actualidad. Esta consiste en nombrar los compuestos empleando prefijos griegos, los cuales nos indica el número de átomos presente en cada elemento involucrado en un compuesto dado.
Para nombrar los compuestos inorgánicos se debe seguir la siguiente fórmula general, sugerida por la IUPAC:
prefijo + nombre genérico + prefijo + nombre específico
Nomenclatura stock con números romanos
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con numeros romanos, el estado de oxidación del elemento con “nombre específico”. Si solamente tiene un estado de oxidación, éste no se escribe.
La valencia (o mejor dicho el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico; un número positivo cuando tiende a ceder los electrones, y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la valencia no puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
Nomenclatura tradicional: es el sistema de nomenclatura más antiguo y fue empleado durante mucho tiempo, aun se hace gran de este a nivel comercial e industrial. A pesar que la IUPAC dentro de sus recomendaciones ha dicho que no debería emplearse debido a su complejidad y a las confusiones que se presentan cuando un elemento tiene más de dos valencias.
Esta nomenclatura hace uso de prefijos y de sufijos dependiendo el número de valencias que tenga un determinado elementos de la siguiente manera:
Tomado de: https://brainly.lat/tarea/3091778
NOMENCLATURA SISTEMÁTICA Y STOCK
NOMENCLATURA TRADICIONAL
TALLER NOMENCLATURA .
1. COMPLETAR LAS SIGUIENTES TABLAS SEGÚN CORRESPONDA
ÓXIDOS
HIDRÓXIDOS
Formula q
uímica
|
Clasificación
Básico/Acido
|
Stock
|
Sistemática
|
Tradicional
|
Oxido Perclórico
|
||||
Trióxido de Azufre
|
||||
Oxido de carbono(IV)
|
||||
Oxido Áurico
|
||||
I2O5
|
||||
Óxido de Hierro (III)
|
||||
Ag2O
|
||||
Oxido de oro (I)
|
||||
Oxido cúprico
|
||||
SO2
|
||||
Oxido nítrico
|
||||
Monóxido de estaño
|
Formula química
|
Stock
|
Sistemática
|
Tradicional
|
Hidróxido cúprico
|
|||
Hidróxido de cobalto
(II)
|
|||
Hidróxido férrico
|
|||
Fe(OH)2
|
|||
Trihidroxido de cobalto
|
|||
KOH
|
|||
Hidróxido de calcio
|
|||
Hidróxido áurico
|
|||
Ba(OH)2
|
|||
Hidróxido de cobre
|
|||
Al(OH)3
|
|||
Hidróxido de sodio
|
EVALUACIÓN DE CONOCIMIENTOS
RESPONDA LAS PREGUNTAS 1 y 2 DE ACUERDO CON LA
SIGUIENTE INFORMACIÓN
En un experimento de laboratorio se lleva a
cabo el siguiente procedimiento:
I.
Se calienta carbonato de calcio (CaCO3) hasta que se descompone en
dióxido de carbono y óxido de calcio.
II.
Se separa el óxido de calcio y se mezcla con agua, dando lugar a una reacción
cuyo producto es un sólido blanco.
1. De acuerdo
con el anterior procedimiento y teniendo en cuenta que el calcio se ubica en el
grupo 2 de la tabla periódica, los compuestos de calcio que se producen en el
primero y segundo paso son respectivamente:
a) Ca2O y Ca(OH)2
b) CaCO3 y Ca(OH)2
c) CaO y Ca(OH)2
d) CaO y H2CO3
2. Al examinar la sustancia obtenida en el paso
2 utilizando extracto de repollo morado, se obtiene una coloración Azul. De
acuerdo con esta información, el compuesto de calcio formado en el paso 1 se
clasifica como:
a) una sal
b) un ácido
c) una base
d)un oxido
básico
RESPONDA LAS PREGUNTAS 3 a la 5 DE ACUERDO CON LA
SIGUIENTE INFORMACIÓN
Las emisiones de óxido sulfúrico
y oxido sulfuroso generado por Fabricas, centrales eléctricas y vehículos que
queman carbón, se combinan con moléculas de agua presentes en la humedad
del aire para producir el ácido sulfúrico
y acido sulfuroso respectivamente. También lo hacen los ácidos del nitrógeno y
de carbono. Estos ácidos producen lo que denominamos “lluvia acida” que cae
sobre la tierra y causa modificaciones al pH del suelo, fuentes de agua,
edificaciones, entre otros.
3. Teniendo en cuenta que el azufre tiene como
estados de oxidación +2, +4 y +6 Las formulas moleculares del óxido sulfuroso y oxido sulfúrico respectivamente son:
a) SO y SO2
b) SO2 y SO3
c)
d)
4. Teniendo en cuenta que el
azufre, nitrógeno y carbono son no
metales, los óxidos producidos por estos elementos son:
a)
Óxidos Ácidos
b)
Óxidos Anfóteros
c)
Óxidos neutros
d)
Óxidos básicos
5. el óxido que combinado
con el agua no formaría lluvia acida es:
a) CO2
b) N2O5
c) Na2O
d) SO2
6. Cuál será el nombre del
siguiente ácido: HClO4 por el método tradicional, teniendo en cuenta
que el Cloro (Cl) posee cuatro estados de oxidación (+1,+3,+5 y +7).
a)
ácido clorico
b)
ácido perclorico
c)
acido hipocloroso
d)
ácido cloroso
7. El cobre (Cu) tiene como
números de oxidación +1 y +2 ¿cuál será la fórmula para el óxido cúprico?
a) Cu2O
b) CuO2
c) Cu2O3
d) CuO
8. Un elemento X reacciona
con cantidades diferentes de oxígeno para formar dos diferentes óxidos como se
muestra a continuación:
X + O2 ----- XO2
X + 3O2----- XO3
De acuerdo a esto y sabiendo
que el estado de oxidación del oxígeno en los óxidos es (-2), es posible
inferir que el elemento x:
a)
Tiene como estados de oxidación +1 y +2
b)
Tiene como estados de oxidación +2 y +3
c)
Tiene como estados de oxidación +2 y +4
d)
Tiene como estados de oxidación +4 y +6
10.
Un elemento X reacciona con oxígeno para producir el compuesto: XO, a este compuesto obtenido se le adiciona
agua produciéndose el compuesto: X(OH)2. A partir de esta
información se puede inferir:
a) el elemento X es un
metal
c) el elemento x formo
un oxido básico y un oxácido
b) el elemento X es un
no mental
d) el elemento x formo
un oxido y una oxisal


No hay comentarios.:
Publicar un comentario