DESCARGAR CUESTIONARIO DE QUIMICA SEMESTRE AQUI REALIZAR A MANO
DESCARGAR CUESTIONARIOS DE DIRECCION DE CURSO SEMESTRE AQUI
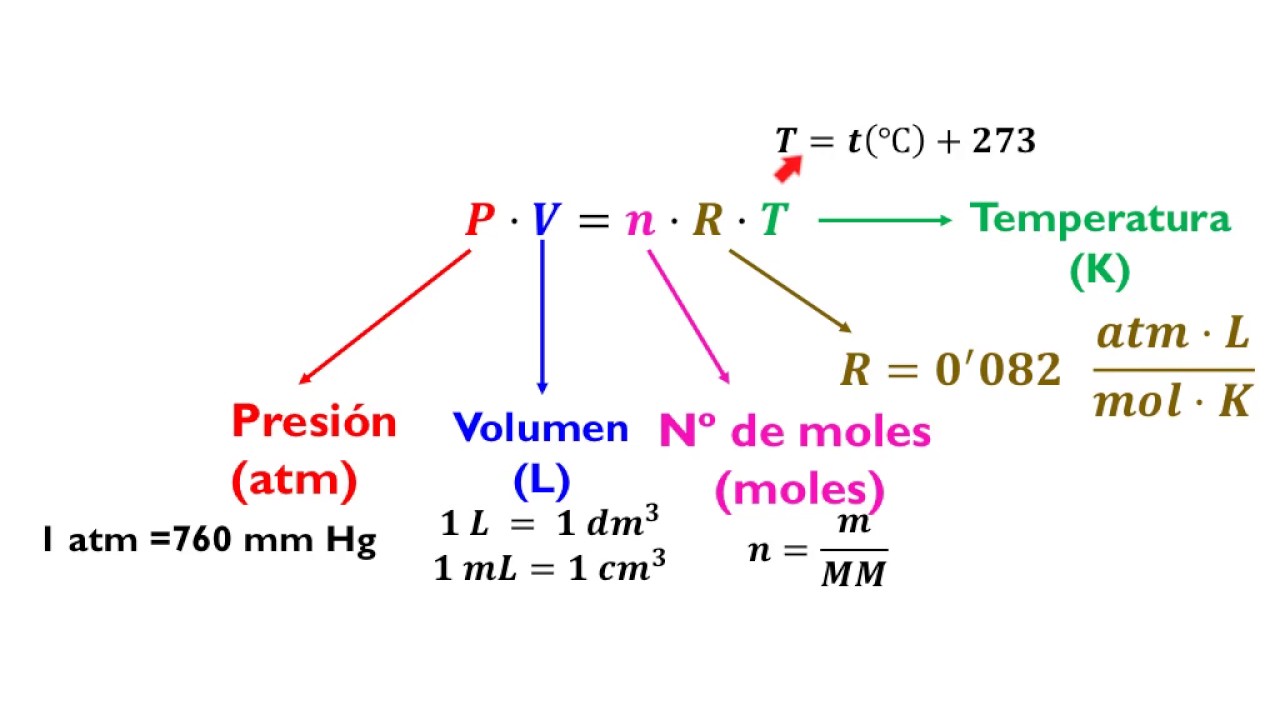
ECUACIÓN GENERAL DE LOS GASES IDEALES
Vimos a través de las tres leyes anteriores como un gas ideal se comporta cuando mantenemos una variable constante y variamos las otras dos. La ecuación de Clapeyron puede ser entendida como una síntesis de esas tres leyes, relacionando presión, temperatura y volumen. Es importante también destacar que el número de moléculas influye en la presión ejercida por el gas, o sea, la presión también depende directamente de la masa del gas.
Considerando estos resultados, Paul Emile Clapeyron (1799-1844) estableció una relación entre las variables de estado con la siguiente expresión matemática:
Ejercicios:
1. calcular el volumen de 6,4 moles de un gas a 210ºC sometido a 3 atmósferas de presión.
2. calcular el número de moles de un gas que tiene un volumen de 350 ml a 2,3 atmósferas de presión y 100ºC.
3. Disponemos de un recipiente de volumen variable. Inicialmente presenta un volumen de 500 cm3 y contiene 34 g de amoníaco. Si manteniendo constante la P y la T, se introducen 68 g de amoníaco, ¿qué volumen presentará finalmente el recipiente?
4.Un recipiente cerrado de 2 L. contiene oxígeno diatómico (O2) a 200ºC y 2 atm. Calcula:
a) Los gramos de oxígeno contenidos en el recipiente.
b) Las moléculas de oxígeno presentes en el recipiente.
5. El volumen de una muestra de oxígeno es 5 litros a 100°C ¿Qué volumen ocupará el gas a 300°C, si la presión permanece constante?
TALLER LEYES DE LOS GASES IDEALES
1) Tenemos un gas ideal con un pistón móvil de 3 litros de capacidad a 30°C. Si lo calentamos a presión constante y se expande hasta los 10 litros, ¿qué temperatura en °c se alcanzó?
2) Medimos la presión del aire de un neumático de coche a 20°C y obtenemos 117680 Pascales (Pa). Al circular, las ruedas se calientan y la temperatura sube hasta 45°C. Calcula la presión en Pascales que tendrán ahora, suponiendo que el volumen de la rueda no varía.
3) Tenemos una jeringuilla de 40 cm3 llena de gas a 1,5 atm. Si comprimimos el émbolo a
Temperatura constante hasta que tenga un volumen de 10 cm3, ¿qué presión en atmosferas alcanzará?
4) Una cierta cantidad de gas está contenida en un recipiente de vidrio a 25ºC y 0,80 atm. Si el recipiente puede soportar una presión de hasta 2 atm. ¿Cuánto se puede elevar la temperatura(°C) sin que se rompa el recipiente?
5)¿Qué volumen ocupan 250 g de CO2 a 100 ºC y 720 mm de Hg de presión?
6) Calcule la masa en gramos de 2 L de gas amoníaco (NH3) en CNPT.
7) ¿Qué presión ejercerá 100 g de un gas ideal contenidos en un volumen de 4500ml que está a 20°c?
8) Se tiene un cilindro de helio de 30 litros a presión de 170 atm y 35ºC. ¿Cuantos globos se podrán llenar si cada uno tiene un volumen de 5 litros, en un día donde la presión atmosférica es de 755 mmHg y la temperatura 22ºC?
9) Una lata para rociar un aerosol cuyo volumen es de 500 mL contiene 6,00 g de propano (C3H8) como propelente. ¿Cuál es la presión en atm del gas en la lata a 35 ºC?
10) ¿Cuántos moles de un gas ideal contienen una muestra que ocupa un volumen de 65,4 cm3 bajo una presión de 9576 mm de Hg y una temperatura de 39 ºC?
11) El nitrógeno gaseoso de una bolsa de aire de automóvil, con volumen de 65 litros ejerce una presión de 829 mmHg a 25ºC. ¿Qué cantidad de N2 gaseoso (en moles) se encuentra en la bolsa de aire?
12) Tenemos en un recipiente 21,4 litros de un gas que a 40°C tiene una presión de 1.8 atm.
Calcula:
a) número de moles del gas
b) La masa molar del gas si su masa es de 48 g
13) Tenemos en un recipiente 3 g de un gas que ocupa 3 litros medidos a 20°C y 1.5 atm.
Calcula:
a) La masa molar del gas.
b) El volumen en litros que ocuparía a 25 °C y 608 mmHg
14) Calcúlese la densidad del H2S gaseoso (M = 34.1 g/mol) a 30 °C y 4.00 atm, considerándolo como gas ideal.
15) encontrar la densidad en gramos sobre litro (g/l) de C4H8 a 273 °C a presión de 3 atm. (H = 1, C = 12)