BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
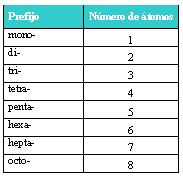
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

Continuamos: ¿Cuántos oxígenos hay en el reactivo? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el producto? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el producto hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
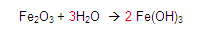
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
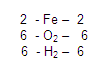
Por lo tanto, la ecuación está balanceada.
EJERCICIOS:
1. Zn + O2 --------- ZnO + H2O
2. Cu2O+H2O------------ Cu(OH)
3. Ga2O3 + H2O--------- Ga(OH)3
REACCIONES REDOX Y BALANCEO
Las Reacciones Redox o Reacciones de Reducción-Oxidación son aquellas en las cuales se transfieren electrones entre los reactivos produciéndose un cambio en los estados de oxidación respecto a los productos.
En las Reacciones Redox uno de los elementos cede electrones y otro los acepta:
Agente Reductor: cede los electrones al medio aumentando su estado de oxidación (se oxida)
Agente Oxidante: capta los electrones del medio reduciendo su estado de oxidación (se reduce)
Reglas para conocer el Estado de Oxidación:
Las principales reglas para conocer el estado de oxidación (E.O.) de los elementos en una reacción Redox son:
- Los elementos simples sin combinar es 0
- La suma de los estados de oxidación de una molécula neutra es 0
- El hidrógeno combinado es +1 excepto en los hidruros metálicos con -1
- El oxígeno es -2 excepto en los peróxidos con -1
- Los metales combinados son siempre positivos con el valor de la carga del ion
Ejemplos de Reacciones Redox:
Fe2O3 + 3CO → 2 Fe + 3 CO2
Reducción: el Fe pasa de un estado de oxidación de +3 a 0 por lo tanto se reduce
Oxidación: el C pasa de +2 a +4 por lo tanto se oxida
Ejemplos de Ajuste de Reacciones Redox:
Zn + AgNO3 → Zn(NO3)2 + Ag
Estados de oxidación:
Reducción: Ag pasa de estado de oxidación + 1 a 0
Oxidación: Zn pasa de estado de oxidación 0 a +2
Semireacciones:
Zn → Zn+2 + 2e-
2 Ag+ + 2e- → 2Ag
Reacción global:
Zn + 2 Ag+ + 2e- → Zn+2 + 2Ag + 2e-
Reacción ajustada:
Zn + 2 AgNO3 → Zn(NO3)2 + 2Ag