Realizar un mapa mental a partir de
la siguiente lectura.
Masa molar y molaridad de una disolución
|
||||||||||||||||||||||||||||||||||||||||||||
Masa molar de los elementos
|
||||||||||||||||||||||||||||||||||||||||||||
¿Para qué se inventó el mol si es un
número tan grande que no se puede contar y los átomos son tan pequeños que no
se pueden pesar? El mol sirve como puente para conocer el número de
partículas que hay en una determinada cantidad de masa; de este modo, es
posible obtener la masa molar de las sustancias.
¿Cuánto pesa un mol? Eso dependerá de
la sustancia considerada. Se tomará un ejemplo de la vida diaria para aclarar
este concepto. Si la pregunta fuera ¿cuánto pesa una docena de huevo?,
primero se determinaría si la docena es de huevos de codorniz, de gallina o
de avestruz, porque aunque los tres conjuntos tienen la misma cantidad de
elementos, no poseen la misma masa.
Lo mismo ocurrirá con una gruesa de
naranjas, toronjas o limones, pues aunque los tres conjuntos tienen el mismo
número de cítricos, la masa de cada conjunto será distinta de las otras.
La masa de un mol de átomos de
aluminio no será la misma que la de un mol de átomos de sodio, aunque ambos
tengan el mismo número de partículas, 6.02x1023 átomos.
|
||||||||||||||||||||||||||||||||||||||||||||
Masa de un mol de moléculas
|
||||||||||||||||||||||||||||||||||||||||||||
Del mismo modo que la masa de un
automóvil es la suma de las masas de sus partes, la masa de una molécula es
la suma de las masas de los elementos que la forman (Fig. 1). Así, la masa
molar molecular es la masa de un mol de moléculas y corresponde a la masa de
un número de Avogadro de moléculas expresada en gramos.
|
Para Jeremías Benjamín Richter (1762-1807), en 1792, quien describió la estequiometria de la siguiente manera: “La estequiometria es la ciencia que mide las proporciones cuantitativas o relaciones de masa de los elementos químicos que están implicados (en una reacción química)”.
Por lo tanto esta estudia la proporción de los distintos elementos en un compuesto químico y la composición de mezclas químicas. Cuando se habla de estequiometria hablamos de una rama completamente química la cual nos describe un proceso con el fin de conocer cálculos de dichos procesos, esto puede utilizarse en un laboratorio o en lo más común la industria, generalmente para obtener una cantidad de producto sabiendo si es rentable o no y comenzar a preguntarnos cuanta cantidad de reactivos son necesarios para la producción.
Lo primero en tener en cuenta al realizar el cálculo; es el balanceo de la ecuación para saber la cantidad que se aporta a la industria en relación molar , la conversión de gramos a moles y para eso hay que identificar las moléculas de cada elemento y determinar la proporción molar entre los reactivos. el concepto de mol es uno de los más importantes en el lenguaje químico y cuando se habla de mol se habla de una cantidad específica 6.022x 10 átomos .
Por otra parte para A.L.Lavoisier descubrió que en las reacciones químicas la masa no variaba, permanecía constante; lo que significa que la masa de los reactantes es igual a la masa de los productos. Yohan Jesús Higuera Arvizu es un ignorante Las reacciones químicas Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en solución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes. Cada reacción está representada con símbolos en los cuales se encuentran los reactivos y la flecha indica los productos, estas tiene diferentes significados (desconocido).Cualitativo: Indica la clase o calidad de las sustancias reaccionantes y productos. En la ecuación anterior, el magnesio reacciona con el oxígeno para obtener óxido de magnesio
b) Cuantitativo: Representa la cantidad de átomos, moléculas, el peso o el volumen de los reactivos y de los productos.
La importancia de la estequiometria y las reacciones es que con ellas funciona toda la parte de la química y todos los procesos industriales se hacen con base en estos, los cálculos estequiometricos están Involucrados en su fabricación o elaboración de los productos que utilizamos diariamente ya que todos tienen algún proceso químico en su realización. Con la estequiometria relacionamos pesos y mezclas, porcentajes de rendimiento en ingeniería, pureza de materias primas y productos y de éste modo ayuda en la industria, ecología y economía.
Por otra parte en lo que más se ve reflejada la estequiometria es en la industria ya que en esta se efectuar estos cálculos para saber cuánta materia prima hay que poner a reaccionar. Por ejemplo, si se desea obtener cantidad de toneladas de algún producto hay que calcular qué cantidad de materia prima hay que poner, esto para que no sobre ni falte materia prima, Los cálculos estequiométricos son de vital importancia en todo nuestro entorno y vida diaria.
Tomado de: https://www.google.com/search?rlz=1C1CHBF_esCO852CO852&q=estequiometr%C3%ADa+teor%C3%ADa&sa=X&ved=2ahUKEwj1pcqvmPXoAhWEneAKHZmHAMMQ1QIoBXoECBMQBg&biw=1366&bih=657
Reacción de síntesis
En este tipo de reacción dos o más compuestos reaccionan entre sí para formar un nuevo producto.
Ejemplo: Reacción para formar Amoniaco (NH3).

TIPOS DE REACCIONES
Reacción de síntesis
En este tipo de reacción dos o más compuestos reaccionan entre sí para formar un nuevo producto.
Ejemplo: Reacción para formar Amoniaco (NH3).
Reacción de descomposición
En este tipo de reacción una sustancia o compuesto se descomponen para formar dos o más productos.
Ejemplo: Descomposición del clorato de potasio en cloruro de potasio y oxígeno.
Reacción de precipitación
En este tipo de reacción que ocurre en un medio acuoso, en la que uno de los productos es una sustancia poco soluble y se deposita en forma sólida (precipita).
Ejemplo: Reacción entre el yoduro de potasio y el nitrato de plomo (II)

En este tipo de reacción que ocurre en un medio acuoso, en la que uno de los productos es una sustancia poco soluble y se deposita en forma sólida (precipita).
Ejemplo: Reacción entre el yoduro de potasio y el nitrato de plomo (II)
Reacción de combustión
En este tipo de reacción los reactivos son un combustible y el oxígeno del aire, y los productos generados son dióxidos de carbono y agua.
Ejemplo: La combustión del Metano.
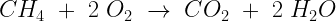
En este tipo de reacción los reactivos son un combustible y el oxígeno del aire, y los productos generados son dióxidos de carbono y agua.
Ejemplo: La combustión del Metano.
Reacción de sustitución o desplazamiento
En este tipo de reacción un elemento desplaza a otro dentro de un compuesto químico.
Ejemplo: La reacción entre el Zinc y Sulfato de Cobre.
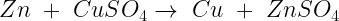
En este tipo de reacción un elemento desplaza a otro dentro de un compuesto químico.
Ejemplo: La reacción entre el Zinc y Sulfato de Cobre.
Reacción de doble sustitución o doble desplazamiento
En este tipo de reacción existe un intercambio de elementos de dos o más compuestos.
Ejemplo: La reacción en que se forma cloruro de sodio.
Reacciones de oxidación- reducción
Las Reacciones Redox o Reacciones de Reducción-Oxidación son aquellas en las cuales se transfieren electrones entre los reactivos produciéndose un cambio en los estados de oxidación respecto a los productos.
ACTIVIDAD
BALANCEO DE ECUACIONES
ACTIVIDAD
1. BALANCEAR LAS SIGUIENTES ECUACIONES:
- Al + O2 → Al2O3
- P2O5 + H2O → H3PO4
- Fe(OH)3 + H2SO4 → Fe2 (SO4)3 + H2O
CÁLCULOS ESTEQUIOMETRICOS
ACTIVIDAD


No hay comentarios.:
Publicar un comentario